
Περιεχόμενο
Για απλούς υπολογισμούς, οι χημικοί δημιούργησαν μια τυποποιημένη μονάδα για τον αριθμό των ατόμων μιας συγκεκριμένης ένωσης που εμπλέκονται σε μια αντίδραση ή σε κάποια άλλη χημική διαδικασία. Ορίζουν ένα mole (mol) ως ποσότητα οποιασδήποτε ουσίας που έχει τον ίδιο αριθμό θεμελιωδών μονάδων με 12 γραμμάρια άνθρακα-12, ο οποίος είναι ο αριθμός Avogadros (6,022 × 1023). Το SI (μετρικό) σύστημα μέτρησης ορίζει ένα χιλιοστόγραμμο (Mmol) ως ένα χιλιοστό του mole. Γενικά, υπολογίζετε τον αριθμό των γραμμομορίων μιας ουσίας ζυγίζοντας το ποσό που διαθέτετε. Αν θέλετε να μετατρέψετε σε Mmol, πολλαπλασιάστε με 103 (1,000).
TL · DR (Πολύ μακρύ;
Ένα mole είναι ίσο με τον αριθμό Avogadros των σωματιδίων μιας συγκεκριμένης ένωσης. Ένα millimole (Mmol) είναι ένα χιλιοστό του μορίου.
Πώς να υπολογίσετε το Moles
Οι ατομικές μάζες μετρώνται σε μονάδες ατομικής μάζας (AMU). Μια AMU είναι ακριβώς το 1/12 της μάζας του πυρήνα ενός ατόμου άνθρακα-12 στην αρχική του κατάσταση. Ένα γραμμάριο μιας ουσίας ορίζεται ότι είναι ίσο με τον αριθμό των σωματιδίων αυτής της ουσίας με τον Avogadros. Σύμφωνα με τον ορισμό αυτό, το βάρος ενός γραμμομορίου μιας ουσίας σε γραμμάρια είναι ο ίδιος με το βάρος ενός επιμέρους σωματιδίου της ουσίας αυτής στην AMU. Για παράδειγμα, το ατομικό βάρος του άνθρακα-12 είναι 12 AMU, έτσι ένα γραμμομόριο άνθρακα-12 ζυγίζει 12 γραμμάρια.
Εξετάστε ένα δοχείο γεμάτο από αέριο υδρογόνο (H2). Κάθε σωματίδιο στο δοχείο είναι ένα μόριο που αποτελείται από δύο άτομα υδρογόνου, οπότε πρέπει να γνωρίζετε μόνο την ατομική μάζα υδρογόνου για να υπολογίσετε το μοριακό βάρος. Στις περισσότερες εκδόσεις του περιοδικού πίνακα παρατίθεται η ατομική μάζα κάθε στοιχείου κάτω από το σύμβολο του. Για το υδρογόνο, το οποίο έχει ένα μόνο πρωτόνιο στον πυρήνα του, το 1,008 AMU του, το οποίο είναι ένας μέσος όρος όλων των φυσικών ισοτόπων του υδρογόνου. Συνεπώς, η ατομική μάζα αερίου υδρογόνου είναι 2.016 AMU, και ένα γραμμομόριο αέριου υδρογόνου ζυγίζει 2.016 γραμμάρια. Για να βρείτε τον αριθμό των γραμμομορίων στο δείγμα σας, ζυγίζετε το δείγμα σε γραμμάρια και διαιρείτε αυτό το βάρος με το μοριακό βάρος του αερίου υδρογόνου σε γραμμάρια. Για παράδειγμα, ένα δείγμα βάρους 15 γραμμαρίων αερίου καθαρού υδρογόνου περιέχει 7,44 γραμμομόρια.
Μετατροπή σε Mmol
Μερικές φορές οι ποσότητες που βρίσκονται υπό διερεύνηση είναι τόσο μικρές ώστε η έκφρασή τους στα σκουλαρίκια είναι δυσκίνητη. Εισάγετε το χιλιοστόγραμμο. Με τον πολλαπλασιασμό του αριθμού των κρεατοελιτών κατά ένα χίλια, μπορείτε να μετατρέψετε ένα πολύ μικρό αριθμό σε ένα πιο εύχρηστο. Αυτό είναι ιδιαίτερα κατάλληλο όταν ασχολείστε με μονάδες όγκου της τάξης των χιλιοστολίτρων.
1 mol = 1.000 ΜιποΙ
Συγκέντρωση διαλύματος
Οι χημικοί χρησιμοποιούν τη γραμμομοριακότητα ως μέτρο συγκέντρωσης μιας συγκεκριμένης ένωσης στο διάλυμα. Ορίζουν τη γραμμομοριακότητα ως τον αριθμό των γραμμομορίων ανά λίτρο. Μετατρέπετε τη γραμμομοριακότητα σε χιλιοστομοριακό ρυθμό πολλαπλασιάζοντας κατά 1.000. Για παράδειγμα, ένα διάλυμα 1 mol (μοριακό, επίσης γραμμένο ως Μ) έχει συγκέντρωση 1 γραμμομόριο ανά λίτρο. Αυτό ισοδυναμεί με ένα διάλυμα 1,000 Mmol (millimolar, επίσης μερικές φορές γραμμένο ως mM), το οποίο είναι ένα διάλυμα που περιέχει 1.000 Mmol ανά λίτρο.
Παράδειγμα
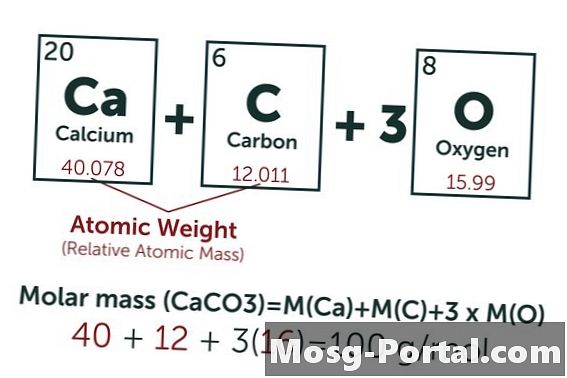
Ένα διάλυμα περιέχει 0,15 γραμμάρια ανθρακικού ασβεστίου. Πόσες χιλιάδες είναι αυτό;
Ο χημικός τύπος ανθρακικού ασβεστίου είναι CaCO3. Το ατομικό βάρος του άνθρακα (C) είναι περίπου 12 AMU, το οξυγόνο (Ο) περίπου 16 AMU και το ασβέστιο (Ca) περίπου 40 AMU. Έτσι, κάθε μόριο ανθρακικού ασβεστίου ζυγίζει 100 AMU, πράγμα που σημαίνει ότι ένα γραμμομόριο ζυγίζει περίπου 100 γραμμάρια. Ένα βάρος 0,15 γραμμαρίων αντιπροσωπεύει 0,15 g ÷ 100 g / mol = 0,0015 moles. Αυτό ισοδυναμεί με 1,5 Mmol.
Ποια είναι η γραμμομοριακή και χιλιομομοριακότητα αυτού του πολύ ανθρακικού ασβεστίου σε 2,5 λίτρα διαλύματος;
Η γραμμομοριακότητα ορίζεται ως ο αριθμός των γραμμομορίων ανά λίτρο, έτσι διαιρέστε τον αριθμό των γραμμομορίων κατά 2,5 για να πάρετε τη γραμμομοριακότητα: 0,0015 ÷ 2,5 =
0,0006 Μ
Πολλαπλασιάστε με 1.000 για να πάρετε το millimolarity =
0,6 mM
Σημειώστε ότι φθάνετε στο ίδιο αποτέλεσμα για millimolarity εάν διαιρέσετε τον αριθμό millimoles από τον όγκο της λύσης.