
Περιεχόμενο
Ο περιοδικός πίνακας οργανώνεται σε στήλες και σειρές. Ο αριθμός των πρωτονίων στον πυρήνα αυξάνεται κατά την ανάγνωση του περιοδικού πίνακα από τα δεξιά προς τα αριστερά. Κάθε σειρά αντιπροσωπεύει επίπεδο ενέργειας. Τα στοιχεία σε κάθε στήλη μοιράζονται παρόμοιες ιδιότητες και τον ίδιο αριθμό ηλεκτρονίων σθένους. Τα ηλεκτρόνια Valence είναι ο αριθμός των ηλεκτρονίων στο εξόχως απόκεντρο επίπεδο ενέργειας.
Αριθμός ηλεκτρονίων
••• Tomasz Wyszoamirski / iStock / Getty ImagesΟ αριθμός των ηλεκτρονίων σε κάθε επίπεδο ενέργειας εμφανίζεται στον περιοδικό πίνακα. Ο αριθμός των στοιχείων σε κάθε σειρά δείχνει πόσα ηλεκτρόνια χρειάζεται για να γεμίσει κάθε επίπεδο. Το υδρογόνο και το ήλιο βρίσκονται στην πρώτη σειρά ή την περίοδο στον περιοδικό πίνακα. Επομένως, το πρώτο επίπεδο ενέργειας μπορεί να έχει συνολικά δύο ηλεκτρόνια. Το δεύτερο επίπεδο ενέργειας μπορεί να έχει οκτώ ηλεκτρόνια. Το τρίτο επίπεδο ενέργειας μπορεί να έχει συνολικά 18 ηλεκτρόνια. Το τέταρτο επίπεδο ενέργειας μπορεί να έχει 32 ηλεκτρόνια. Σύμφωνα με την αρχή Aufbau, τα ηλεκτρόνια θα γεμίσουν πρώτα τα χαμηλότερα επίπεδα ενέργειας και θα χτίσουν στα υψηλότερα επίπεδα μόνο εάν το επίπεδο ενέργειας είναι γεμάτο.
Τα τροχιακά


••• Roman Sigaev / iStock / Getty Images
Κάθε επίπεδο ενέργειας αποτελείται από περιοχές γνωστές ως τροχιακές. Ένα τροχιακό είναι μια περιοχή πιθανότητας στην οποία μπορούν να βρεθούν ηλεκτρόνια. Κάθε επίπεδο ενέργειας, εκτός από το πρώτο, έχει περισσότερα από ένα τροχιακά. Κάθε τροχιά έχει ένα συγκεκριμένο σχήμα. Αυτό το σχήμα καθορίζεται από την ενέργεια που διαθέτουν τα ηλεκτρόνια στο τροχιακό. Τα ηλεκτρόνια μπορούν να κινούνται οπουδήποτε στο σχήμα του τροχιακού τυχαία. Τα χαρακτηριστικά κάθε στοιχείου καθορίζονται από τα ηλεκτρόνια στο τροχιακό.
Το S τροχιακό
••• Archeophoto / iStock / Getty ImagesΤο s-τροχιακό έχει σχήμα σφαίρας. Το s-τροχιακό είναι πάντα το πρώτο που θα γεμίσει σε κάθε επίπεδο ενέργειας. Οι δύο πρώτες στήλες του περιοδικού πίνακα είναι γνωστές ως το s-block. Αυτό σημαίνει ότι τα ηλεκτρόνια σθένους για αυτές τις δύο στήλες υπάρχουν σε ένα s-τροχιακό. Το πρώτο επίπεδο ενέργειας περιέχει μόνο ένα s-τροχιακό. Για παράδειγμα, το υδρογόνο έχει ένα ηλεκτρόνιο στο s-τροχιακό. Το ήλιο έχει δύο ηλεκτρόνια στο s-τροχιακό, γεμίζοντας το επίπεδο ενέργειας. Επειδή το επίπεδο ενέργειας του ηλίου γεμίζει με δύο ηλεκτρόνια, το άτομο είναι σταθερό και δεν αντιδρά.
Το P Orbital
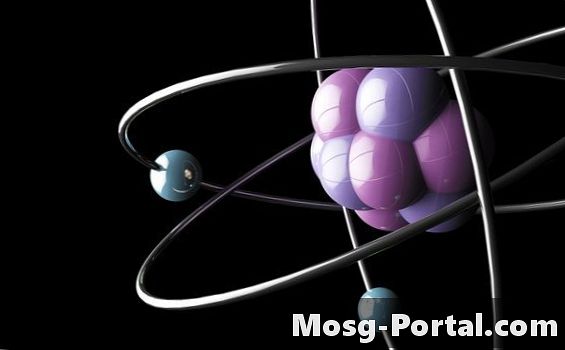
Το π-τροχιακό αρχίζει να γεμίζει μόλις γεμίσει το s-τροχιακό σε κάθε ενεργειακό επίπεδο. Υπάρχουν τρία π-τροχίσματα ανά ενεργειακό επίπεδο, καθένα διαμορφωμένο σαν μια λεπίδα έλικας. Κάθε ένα από τα p-τροχιακά κρατά δύο ηλεκτρόνια, για ένα σύνολο έξι ηλεκτρονίων στα ρ-τροχιακά. Σύμφωνα με τον κανόνα του Hund, κάθε p-τροχιακό ανά ενεργειακό επίπεδο πρέπει να λαμβάνει ένα ηλεκτρόνιο πριν κερδίζει ένα δεύτερο ηλεκτρόνιο. Το π-μπλοκ αρχίζει με τη στήλη που περιέχει βόριο και τελειώνει με τη στήλη ευγενών αερίων.
Τα τροχιακά D και F

Τα d- και f-τροχιακά είναι πολύ περίπλοκα. Υπάρχουν πέντε d-orbitals ανά ενεργειακό επίπεδο, ξεκινώντας από το τρίτο επίπεδο ενέργειας. Τα μεταβατικά μέταλλα συνθέτουν τα δ-τροχιακά. Υπάρχουν επτά φ-τροχιακά ανά ενεργειακό επίπεδο ξεκινώντας από το πέμπτο επίπεδο ενέργειας. Η λανθανίδη και ακτινίδιο αποτελούν τα φ-τροχιακά.