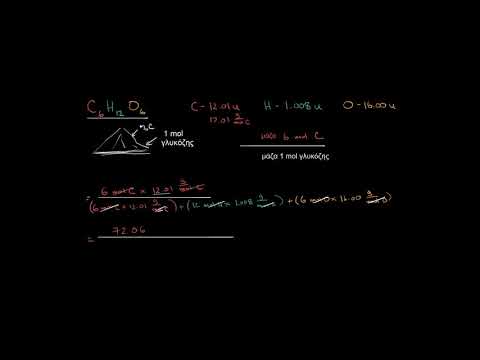
Περιεχόμενο
Για να υπολογίσετε τη μοριακή μάζα μιας ένωσης, πρέπει να γνωρίζετε δύο πράγματα. Ο πρώτος είναι ο μοριακός τύπος και ο δεύτερος είναι ο ατομικός αριθμός μάζας καθενός από τα στοιχεία που το αποτελούν. Ο ατομικός αριθμός μάζας για κάθε στοιχείο παρατίθεται σε μονάδες ατομικής μάζας κάτω από το σύμβολο του στον περιοδικό πίνακα. Η μονάδα αυτή ορίζεται με τέτοιο τρόπο ώστε ο αριθμός μάζας κάθε στοιχείου να αντιστοιχεί στη μάζα ενός γραμμομορίου του στοιχείου σε γραμμάρια. Ένα mole είναι ίσο με τον αριθμό Avogadros (6.02 x 1023) ατόμων ή μορίων.
TL · DR (Πολύ μακρύ;
Για να βρείτε τη μάζα ενός γραμμομορίου ενός συγκεκριμένου μορίου, προσθέστε τις ατομικές μάζες καθενός από τα συστατικά του στοιχεία. Μπορείτε να τα δείτε στο περιοδικό πίνακα.
Ο μοριακός τύπος
Τα άτομα συνδυάζονται με διάφορους τρόπους σύμφωνα με τον αριθμό των ηλεκτρονίων που έχει το καθένα στο εξωτερικό του κέλυφος. Ιονικές ενώσεις, όπως το χλωριούχο νάτριο (NaCl), μπορεί να αποτελούνται από ένα μόνο άτομο, το καθένα από τα δύο διαφορετικά στοιχεία, και μερικά ομοιοπολικά αέρια, όπως υδρογόνο (Η2) και οξυγόνο (Ο2) αποτελούνται από δύο άτομα του ιδίου στοιχείου. Μερικά μόρια, ιδιαίτερα αυτά που σχηματίζονται με άνθρακα, μπορούν να έχουν πολύ μεγάλο αριθμό ατόμων συστατικών. Για παράδειγμα, γλυκόζη (C6H12Ο6) έχει 24 μεμονωμένα άτομα.
Ανεξάρτητα από το πόσο μεγάλο ή μικρό το μόριο, η διαδικασία για τον υπολογισμό της μοριακής μάζας του είναι το ίδιο. Αναζητάτε την ατομική μάζα καθενός από τα στοιχεία του τύπου, πολλαπλασιάζετε τον με τον αριθμό των ατόμων αυτού του στοιχείου στην ένωση και προσθέστε την σε όλους τους άλλους. Αυτό σας δίνει τη μάζα, σε γραμμάρια, ενός μορίου του μορίου.
Αναζητώντας ατομικούς αριθμούς μάζας
Όλα τα στοιχεία είναι διατεταγμένα στον περιοδικό πίνακα σύμφωνα με τον αυξανόμενο ατομικό αριθμό, ο οποίος αντιστοιχεί στον αριθμό των πρωτονίων στον πυρήνα. Το υδρογόνο έχει ένα πρωτόνιο, οπότε έρχεται πρώτο, ενώ το οξυγόνο έχει οκτώ πρωτόνια, οπότε το όγδοο. Ο ατομικός αριθμός δεν είναι ο ίδιος με την ατομική μάζα, όμως, επειδή πρέπει επίσης να προσθέσετε τη μάζα των νετρονίων στον πυρήνα. Τα ηλεκτρόνια είναι τόσο μικρά και ελαφρά ώστε το βάρος τους θεωρείται αμελητέο. Η ατομική μάζα, που είναι το άθροισμα όλων των πρωτονίων και νετρονίων, παρατίθεται κάτω από το σύμβολο για κάθε στοιχείο.
Γύρω από το πλησιέστερο ακέραιο: Οι αριθμοί ατομικής μάζας συνήθως περιλαμβάνουν ένα δεκαδικό κλάσμα. Αυτό συμβαίνει επειδή κάθε στοιχείο έχει ένα ή περισσότερα φυσικά ισότοπα, τα οποία είναι εκδόσεις που περιέχουν ένα ή περισσότερα επιπλέον νετρόνια ή λείπουν ένα ή περισσότερα. Ο αριθμός μάζας λαμβάνει υπόψη όλα αυτά τα ισότοπα, αλλά για τους πιο πρακτικούς σκοπούς, δεν χρειάζεται να το κάνετε αυτό. Γι 'αυτό συνήθως στρογγυλεύετε τον μαζικό αριθμό στον πλησιέστερο ακέραιο αριθμό. Για παράδειγμα, ο περιοδικός πίνακας παραθέτει τον αριθμό ατομικής μάζας οξυγόνου ως 15.999. Για τους περισσότερους πρακτικούς σκοπούς, μπορείτε να το στρογγυλοποιήσετε σε 16. Ο αριθμός μάζας σας λέει ότι ένα γραμμομόριο οξυγόνου έχει μάζα 16 γραμμαρίων.
Παράδειγμα
Ποια είναι η μοριακή μάζα της γλυκόζης σε γραμμάρια;
Ο χημικός τύπος γλυκόζης είναι C6H12Ο6. Ο περιοδικός πίνακας σας λέει ότι η ατομική μάζα του άνθρακα (C) είναι 12, αυτή του υδρογόνου (Η) είναι 1 και αυτή του οξυγόνου (Ο) είναι 16. Το μόριο γλυκόζης έχει 6 άνθρακες, 12 υδρογόνα και 6 οξυγόνα. η μοριακή μάζα είναι (6 · 12) + (12 · 1) + (6 · 16) = 180. Συνεπώς, ένα γραμμομόριο γλυκόζης έχει μάζα 180 γραμμαρίων. Αν θέλετε να βρείτε τη μάζα περισσότερο από ένα mole, πολλαπλασιάστε το ποσό σε γραμμάρια με τον αριθμό των mole.